乙醇汽油的主要成分有CH4吗_乙醇汽油含汽油吗
1.化学物质的俗称
2.2005全国初三化学竞赛试卷
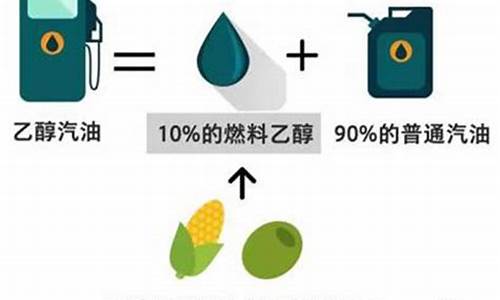
(1)图1中公交车使用的天然气主要成分是甲烷;甲烷完全燃烧的化学方程式为:CH4+2O2
| ||
| ? |
故答案为:甲烷;CH4+2O2
| ||
| ? |
(2)氢气在空气中燃烧的化学方程式为:2H2+O2
| ||
| ? |
氢动力汽车目前还不能普及,原因是没有找到比较经济的生产氢气的方法,氢气不易贮存等.
故答案为:2H2+O2
| ||
| ? |
(3)由表中数据和质量守恒定律可知,乙醇和氧气反应能生成一氧化碳、二氧化碳和水,反应的化学方程式为:2C2H5OH+5O2
| ||
| ? |
解:设生成二氧化碳、一氧化碳水的质量分别为X、Y、Z.?
2C2H5OH+5O2
| ||
| ? |
| 160 |
| 40 |
| 88 |
| X |
| 56 |
| Y |
| 108 |
| Z |
乙醇中碳元素的质量分数为:
| 24 |
| 46 |
汽油中碳元素的质量分数为:
| 96 |
| 114 |
则相同条件下,乙醇和汽油分别燃烧时,产生CO较多的是汽油.
足够多的氧气或增大可燃物与氧气的接触面积可以促进可燃物燃烧.
故答案为:3:4;汽油;足够多的氧气(或与氧气有足够大的接触面积)(其他合理的答案也给分).
化学物质的俗称
壹、 初中化学常见物质的颜色
(一)、固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡**固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、**溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体.贰、初中化学常见物质1 高锰酸钾:俗名灰锰氧,化学式KMnO4,医学上常用作消毒剂.
2、氯化钠:俗名食盐,化学式NaCl,可以作为重要的调味品、防腐剂、融雪剂等.
3、碳酸钠:俗名纯碱、苏打,化学式Na2CO3,广泛用在洗涤剂、玻璃、造纸、纺织等工业上.
4、碳酸氢钠:俗名小苏打,化学式NaHCO3,是焙制面食糕点的发酵粉、治疗胃酸过多症的药剂.
5、氢氧化钠:俗名烧碱、火碱和苛性钠,化学式NaOH,广泛用于肥皂、石油、造纸、纺织和印染等工业,厨房清洁剂就含有氢氧化钠.
6、碳酸钙:大理石、石灰石的主要成分,化学式CaCO3,大量用于建筑,制取水泥的原料.
7、氢氧化钙:俗名熟石灰、消石灰,化学式Ca(OH)2,其水溶液俗称石灰水,常用于改良酸性土壤,用作建筑材料,配制波尔多液、石硫合剂等.
8、氧化钙:俗名生石灰,化学式CaO,作为食品干燥剂.
9、过氧化氢:俗名双氧水,化学式H2O2,医学上用作消毒剂.
10、五水合硫酸铜:俗名胆矾、蓝矾,化学式CuSO4?5H2O 农业上用作杀菌剂,与石灰配制农药波尔多液,体育上用于游泳池消毒.
11、甲烷:天然气和沼气的主要成分,化学式为CH4,是重要的气态燃料.
12、乙醇:俗名酒精,化学式C2H5OH,酒类饮料的主要成分,车用乙醇汽油中添加10%乙醇,属于可再生绿色能源.
13、乙酸:俗名醋酸,化学式CH3COOH,通常的食醋中约含3%-5%的乙酸.
14、固态二氧化碳:俗名干冰,化学式CO2,用于人工降雨、特景拍摄等.
15钡餐,重晶石 Baso4
2005全国初三化学竞赛试卷
常见化学物质俗称大全
一、硫酸盐类:
1.皓矾: ZnSO4·7H2O
2.钡餐,重晶石: BaSO4
3.绿矾,皂矾,青矾: FeSO4·7H2O
4.芒硝,朴硝,皮硝: Na2SO4·10H2O
5.明矾: KAl(SO4)2·12H2O
6.生石膏:CaSO4·2H2O 熟石膏:2CaSO4·H2O
7.胆矾、蓝矾:CuSO4·5H2O
二、矿石类:
1.黄铜矿: CuFeS2
2.磁铁矿石: Fe3O4
3.赤铁矿石:Fe2O3
4.褐铁矿石: 2Fe2O3·3H2O
5.菱铁矿石:Fe2CO3
6.石英:SiO2
7.刚玉(蓝宝石.红宝石):天然产的无色氧化铝晶体
8.黄铁矿(愚人金):FeS2
9.智利硝石:NaNO3
10.大理石(方解石、石灰石):CaCO3
11.孔雀石:CuCO3·Cu(OH)2
12.辉铜矿:Cu2S
三、气体类:
1.高炉煤气:CO,CO2等混合气体
2.水煤气:CO,H2
3.天然气(沼气):CH4
4.液化石油气:C3H8,C4H10为主
四、其他类:
1.白垩: CaCO3
2.石灰乳:Ca(OH)2
3.足球烯: C60
4.铜绿:Cu2(OH)2CO3
5.纯碱(碱面): Na2CO3
6.王水: HCl,HNO3 (3:1)
7.水玻璃(泡火碱) :Na2SiO3
8.小苏打:NaHCO3
9.苏打:Na2CO3
10.大苏打(海波):Na2S2O3
11.盐卤:MgCl2·6H2O
12.雌黄:As2S3
13.雄黄:As4S4
14.朱砂:HgS
15.石棉:3MgO·2SiO2·2H2O
16.砒霜:As2O3
17.泻盐:MgSO4·7H2O
18.波尔多液:CuSO4+Ca(OH)2
19.钛:TiO2
氯化钠;食盐 NaCl
氯化镁;盐卤 MgCl2·6H2O
碳酸钠;苏打,纯碱 Na2CO3
碳酸氢钠;小苏打 NaHCO3
氢氧化钠;烧碱,苛性钠 NaOH
氢氧化钾;苛性钾 KOH
氢氧化钙;熟石灰 Ca(OH)2
高锰酸钾;灰锰氧 KMnO4
氟化钙;萤石 氟石 CaF2
二硫化亚铁;黄铁矿 硫铁矿 FeS2
硫酸铜晶体;胆矾 蓝矾 CuSO4·5H2O
硫酸锌晶体;皓矾 ZnSO4·7H2O
硫酸亚铁晶体;绿矾 FeSO4·7H2O
硫酸铝晶体;明矾 KAl(SO4)2·12H2O
硫酸钙晶体;(生)石膏 CaSO4·2H2O
硫酸钙晶体;熟石膏 烧石膏(CaSO4)2·H2O
硫酸钡晶体;重晶体 BaSO4
硫酸钠晶体;芒硝 NaSO4·10H2O
硫酸镁晶体;泻盐 MgSO4·7H2O
硫代硫酸钠;大苏打 海波 Na2S2O3
硝酸钾;硝石 火硝 KNO3
硫酸钙 CaSO4
过磷酸钙(普钙)Ca(H2PO4)2·H2O
磷酸二氢钙;重过磷酸钙Ca(H2PO4)2
一氧化碳和氢气;水煤气 CO和H2
一氧化碳和二氧化碳;发生炉煤气 CO和CO2
二氧化碳(固体);干冰 CO2
碳酸钙;石灰石 方解石 大理石 白垩 CaCO3
氧化钙;生石灰 CaO
碳化钙;电石 CaC2
碳化硅;金刚砂 SiC
二氧化硅;石英 水晶 SiO2
硅酸钠溶液;水玻璃 泡花碱 Na2SiO3
氧化铝;刚玉 Al2O3
亚铁氰化钾;黄血盐K4<Fe(CN)6>3H2O
铁氰化钾;赤血盐 K3<Fe(CN)6>
碱式碳酸铜;铜绿 Cu2(OH)2CO3
漂;Ca(ClO)2和CaCl2
王水; 浓HNO3和浓HCl(1:3)
氧化砷;砒霜 As2O3
硫化砷;雄黄 As2S3
氯化汞;升汞 HgCl2
;三仙丹 HgO
硫化汞;辰砂 HgS
2005年全国初中学生化学素质和实验能力竞赛辽宁赛区初赛试题
考生注意:本试卷共五道大题,满分100分,考试时间100分钟。
可能用到的相对原子质量:
H—1 C—12 N—14 0—16 Na—23 Cl—35.5 Ag—108
一、选择题(本题共20分。1~10小题只有一个选项符合题意,每小题1分 11~15小题有1或2个选项符合题意,每小题2分。)
1. 我省已开始使用乙醇汽油。乙醇汽油就是在汽油中加入适量的乙醇混合而成的一种燃料。下列叙述中错误的是 ( )
A.乙醇汽油是一种新型化合物 B.汽车使用乙醇汽油能减少有害气体的排放
C用石油可炼制汽油 D.用玉米、高梁等发酵可以制得乙醇
2. 油炸食物不宜多吃,因为食物长时间煎炸后所产生的微量的丙烯醛(化学式C3H40)等有毒物质,会损害人体健康,下列有关丙烯醛的说法不正确的是 ( )
A.由碳、氢、氧三种元素组成 B.碳、氢、氧元素的质量比是9:1:2
C.分子中碳、氢、氧原子个数比为3:4:1 D.在空气中完全燃烧的产物是二氧化碳和水
3. 将mgKN03的不饱和溶液恒温蒸发水分,直至有晶体析出。在此变化过程中,溶液中溶质质量分数(a%)与蒸发时间(t)的变化关系可用下图表示的是 ( )
4. 手机使用的锂电池是新型的高能电池,以质量轻、电容量大而受到重视。某种锂电池的总反应可表示为Li+Mn02=LiMn02。下列说法中正确的是 ( )
A. LiMn02为新型的氧化物 B.LiMn02为锂、锰、氧的合金
C. 该反应属于化合反应 D.该反应中Mn的化合价没有变化
5.在NH4NO3、N2、N02、NO这4种物质中,N元素表现出的化合价共有 ( )
A.2种 B.3种 C.4种 D.5种
6.新买的铝锅、铝壶用来烧开水时,凡是水浸到的地方都会变黑,这是由于水中含有可溶性的 ( )
A.钠盐 B.镁盐 C.铁盐 D.钙盐
7.下列化学实验基本操作,正确的是 ( )
A.稀释浓硫酸时,把浓硫酸慢慢倒入盛水的量筒中并搅拌
B.用托盘天平称量药品时,称量物放在左盘,砝码放在右盘
C.用滴管滴加液体时,滴管应紧贴试管内壁
D.向燃着的酒精灯里添加酒精
8.兰草的叶子舒展、大方且叶色浓绿,广为人们喜欢。为了使兰草生长的更旺盛,通常给它施的肥是 ( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥
9.1828年德国化学家维勒,将一种无机物的水溶液加热得到了尿素(NH2CONH2),开创了有机化学人工合成的新纪元。维勒使用的无机物是 ( )
A.(NH4)2C03 B.NH4N03 C.CH3COONH4 D.NH4CNO
10.当水的温度和压强升高到临界点(t=374.3℃,p=22.05MPa)以上时,水就处于超临界状态,该状态的水即称之为超临界水。超临界水具有通常状态下水所没有的特殊性质,它可以和空气、氧气及一些有机物质均匀混合。如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水等小分子化合物。有关超临界水的叙述错误的是 ( )
A.超临界水可处理有机废物 B.超临界水是一种新物质
C.超临界水是水的一种状态 D.超临界水氧化技术不形成二次污染
11.某同学设计了一些准备在实验室制取有关气体的方案,其中合理可行的是 ( )
A.加热氯酸钾与高锰酸钾的混合物制氧气
B.用硝酸与锌反应制氢气
C.用稀盐酸与生石灰反应制二氧化碳
D.用稀硫酸与石灰石反应制二氧化碳
12.下列各组物质的稀溶液能发生反应,但无明显现象的是 ( )
A.Na2C03和H2S04 B.CuS04和NaOH C.HCI和NaOH D.KCI和NaNO3
13.向AgN03、Cu(N03)2的混合溶液中加入一些铁粉,完全反应后过滤。不可能存在的情况是 ( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+
B.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+
C.滤纸上有Ag、Cu、Fe,滤液中有Fe2+
D.滤纸上有Ag、Cu、Fe,滤液中有Ag+、Cu2+
14.你认为下列实验方案中,可行的是()
A.按溶解、过滤、蒸发的操作顺序可以分离CaCl2、CaCO3的混合物
B.向未知溶液中加入AgNO3溶液,产生白色沉淀,证明溶液是盐酸
C.用磷在密闭容器中燃烧,除去密闭容器中的氧
D.将pH试纸润湿后,用玻璃棒蘸取食用白醋滴到试纸上,测定其pH
15.在20世纪20年代,一些化学家提出一种酸碱理论——质子论。这种理论认为,凡能给出质子(H+)的分子或离子都是酸;凡能接受质子的分子或离子都是碱。根据这一理论,下列物质中不属于碱的是 ( )
A.HN03 B.HC03 C.NH+4 D.S024
二、填空题(本题共22分)
16 (3分)一些食物的近似pH如下表:
食物 苹果 葡萄 牛奶 玉米
pH 2.9~3.3 3.5~4.5 6.3~6.6 6.8~8.0
(1)苹果汁和葡萄汁相比较,酸性较强的是___,它能使石蕊试液变___色;
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是___。
17.(2分)臭氧(化学式O3)在通常状况下是淡蓝色、有鱼腥臭味的气体。臭氧不稳定,受热极易转化为氧气,并放出大量热,臭氧的氧化能力比氧气强很多。若将氧气通过臭氧发生器,在放电条件下,从臭氧发生器出来的氧气中含有3%的臭氧。
(1)O2和O3性质不同的原因是___;
(2)将带火星的木条伸入盛有臭氧的集气瓶中,可以看到___的现象。
18.(2分)如图所示,两根玻璃棒逐渐靠近但不接触,却产生大量的白烟。已知NH3+HCl=NH4CI,NH4Cl在常温下是白色固体。请回答下列问题:
(1)产生白烟的缘故是___;
(2)该现象说明分子具有___的性质。
19.(5分)近年来,许多城市在公交车和出租车上推行以天然气代替汽油作燃料,不少公交车和出租车上印有“CNG”的标志,代表它们是以压缩天然气为燃料的汽车。这一改革的目的是___,天然气的主要成分是___,该主要成分燃烧的化学方程式是___。天然气的主要成分若在煤矿的矿井里达到一定的浓度,遇到明火就会发生爆炸,称为瓦斯爆炸,为了防止瓦斯爆炸,煤矿矿井内必须取的安全措施是___。
20.(4分)已知置换反应:A+B→C+D。
(1)若D为氢气,B为稀硫酸,则A的选择应满足的条件是___;
(2)若D为铜,化合物B的物质类别可能为___。
21.(6分)下图A是一种用于显示事物异同点的信息处理方法。两个圆分别代表金刚石和石墨的有关信息,两圆重叠的区域表示金刚石和石墨的共同特征,重叠区域以外的部分表示它们的独有特征。请你在下面的空格内填写与图B、图C中(1)、 (2)、 (3) 区域对应的适当内容(每处只要求填一点)。
(1) ______________________________
(2) ______________________________
(3) ______________________________
三、简答题(本题共24分)
22.(3分)夏天来临,同学们又可以畅饮汽水了。在购买和贮存玻璃瓶汽水时,要注意如下问题:①不要猛力碰撞;②不要在阳光下曝晒;③不要长时间贮藏在冰箱的冷冻室里。请用你所学的化学知识加以解释。
23.(2分)为了延长食品的保质期,可用真空包装的原因是什么?另外,工业上还可以用向食品袋里充入某种性质不活泼的气体的办法,该气体可能是什么?
24.(4分)房屋失火后常用水来扑灭,实验室熄灭酒精灯则是用灯帽将其盖灭。这两种灭火方法依据的原理依次是:________、________。请你依据上述原理,各举一种生活中常用的灭火方法:________、______________。
25.(6分)已知某不纯的硝酸钠中混有一种、两种或三种杂质,为了确定不纯的硝酸钠溶液中所含杂质的成分,一位同学设计了以下实验过程:
请回答下列问题:
(1)操作I和Ⅱ是____________。
(2)经分析,杂质成分的可能性有以下几种情况:(用化学式表示)
若含有一种杂质,则是_________________;
若含有两种杂质,则可能是_______________;
若有三种杂质,则可能是________________。
26.(9分)用氯气或液氯消毒饮用水时,会和水中的有机物发生反应,生成对人体有毒的有机物。因此,世界环保联盟将全面禁止用氯气对饮用水消毒,建议推广用安全、高效杀菌消毒剂Cl02。
Cl02是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解。C102易与碱反应,其杀菌、漂白能力均优于Cl2,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的臭味。
(1)制取Cl02的方法有多种,目前欧洲一些国家用NaCl03氧化浓盐酸制取Cl02(Kestiog法)同时有Cl2生成,该反应的化学方程式为________________。
(2)国最近研究成功用Cl2氧化NaCl02(N2保护下)制取CIO2,该反应的化学方程式是___________;此法与Kestiog法相比,其优点是___。
(3)工业上也可以在60℃时,、用稍加潮湿的KClO3与草酸(HOOCCOOH)反应制取Cl02。某实验小组用下图所示装置制取并收集Cl02,在装置图中A为Cl02的发生装置,B为Cl02的收集装置,C为尾气吸收装置。请问:
①为了保证实验成功,在A装置外面需加___、B装置外面需加___;
②C中所盛放的药品是___。
四、实验题(本题共21分)
27.(6分)通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,请你结合下列装置图回答问题:
(1)加热固体物质制取气体,可选用的发生装置是___;
(2)实验室制取C02应选用的发生装置是___,理由是_______________;
(3)选用E和F收集气体,分别利用的性质是____________________;
(4)小林准备用装置B加热KMn04来制取O2,你认为这样做可能产生的后果是_______________。
28.(8分)李同学在探究铁生锈的条件时,将铁钉浸没在试管里的食盐水中,一段时间后,发现试管底部出现了黑色粉末。李同学对此黑色粉末的组成做了如下几种猜测:
①Fe;②Fe203;③Fe304;④FeCl3;⑤数种物质的混合物。
请回答下列问题:
(1)你认为李同学的上述猜测中,不做实验就可排除的是:___和___(填序号),理由是___;你认为黑色粉末还可能是___,理由是___。
(2)李同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论:黑色粉末一定是铁粉。你认为李同学的结论对吗?____________,理由是___。
29.(7分)某食品包装袋内有一个小纸袋,上面写着“干燥剂,主要成分是生石灰”。
(1)生石灰(CaO)可作干燥剂的理由是(用化学方程式表示)
________________________________
(2)某同学对干燥剂作了一系列探究,其实验方案如下,请你完成下列实验报告。
问题与猜想 实验步骤 实验现象 实验结论
问题1:小纸袋中的物质能否继续作干燥剂? 取足量小纸袋中固体放入烧杯中,加入适量水,触摸杯壁。 不发热
问题2:猜想变质后的物质可能是什么?_______
五、计算题(本题共13分)
30. (6分)电解18能产生多少克氧气?甲、乙两位同学分别用了两种不同的计算方法。
甲同学的解法 乙同学的解法
解:设产生氧气的质量为x
36 32
18g x
答:能产生16g氧气。
解:水分子中氧元素的质量分数:
=88.89%
氧气的质量为:18×88.89%=16g
答:能产生16g氧气。
请你回答下列问题:
(1)你认为他们的解题思路和方法都正确吗?
(2)对“17g过氧化氢完全分解(化学方程式为:)能产生多少克氧气?”一题,你认为也能用上述两种方法解答吗?试试看,请把能用的解法过程写出来。
(3)你认为在什么情况下,甲、乙两位同学的解法都能使用?
31.(7分)有一种由氯化钠和硝酸钠组成的固体混合物12.35g,加入27使其完全溶解,滴入硝酸银溶液75g,恰好完全反应,生成氯化银沉淀14.35g。计算.:
(1)混合物中,氯化钠的质量。
(2)反应后滤液中溶质的质量分数。
参考答案及评分标准
说明:
1.各类题目中,只要考生回答合理,均按正确答案给分.
2.书写化学方程式时,化学式有错误、未配平或未注明反应条件的不得分.
一、选择题(共20分)
1.A 2.B 3.D 4.C 5.D
6.C 7.B 8.A 9.D 10.B
11.A 12.C 13.B、D 14.A、C 15.A、C
二、填空题(共22分)
16.(每空1分)(1)苹果汁;红 (2)玉米
17.(每空1分)(1)O2和O3的分子构成不同:(2)木条立即燃烧
18.(每空1分)(1)NH3和HCl反应生成了白色固体NH4Cl颗粒:(2)不断运动
19.减少大气污染,改善城市空气质量(1分);CH4(1分);
(2分): 通风、严禁烟火(1分)
20.(每空2分)(1)在金属活动性顺序中,排在氢前面的金属 (2)盐或氧化物
21.(每空2分)(1)还原性、可燃性、双原子分子、气体、难溶于水等
(2)都是化合物、都能发生复分解反应、水溶液可使指示剂变色等
(3)与酸性氧化物反应、与酸反应等
三、简答题(共24分)
22.①汽水中溶有C02气体,且瓶内的压强高于瓶外。受到撞击时,瓶壁所受压力失衡,玻璃瓶会发生爆裂,伤及人身;(1分)②在阳光照射下,瓶内的温度升高,C02的溶解度减少,从汽水中逸出,瓶内的压强骤增,导致玻璃瓶爆裂:(1分)③冷冻时间过长,汽水结成冰,体积膨胀,使玻璃瓶破裂。(1分)
23.防止食品与氧气(或空气)接触而腐败变质(1分): N2(1分)。
24.将可燃物温度降低到着火点以下(1分);将可燃物与空气隔绝(1分);吹灭蜡烛等(1分):用锅盖盖灭着火的油锅等(1分)
25. (1)过滤(1分):(2)CaCl2(1分);
CaCl2和NaCl或CaCl2和Ca(N03)2或Ca(N03)2和NaCl(3分)
CaCl2、NaCI、Ca(N03)2(1分)
26.(1)2NaCl03+4HCl=2Cl02↑+Cl2↑+2H20+2NaCl (2分)
(2)2NaCl02+Cl2=2Cl02↑+2NaCl(2分)无有害气体生成,产品易分离(2分)
(3)60℃水、冰水(2分)②NaOH(1分)
四、实验题(共21分)
27.(每空1分)(1)A (2)C;反应物是固体和液体且不需要加热
(3)密度比空气大;不易溶于水 (4)试管破裂,少量高锰酸钾粉末会冲出试管。
28.(1)②(1分):④(1分); Fe203是红棕色的(1分);FeCl3溶于水(1分) 碳粉(1分);制造铁钉的铁是铁碳合金(1分)
(2)不对(1分);四氧化三铁能被磁铁吸引(1分)
29.(7分)(1) CaO+H20=Ca(OH)2 (1分).
不能作干燥剂(1分)
碳酸钙(1分) 取小纸袋中少量固体于试管中,加入稀HCI(2分) 有气泡产生(1分) 固体中有碳酸钙(1分)
或取小纸袋中少量固体于试管中,加入稀HCl,并把产生的气体通入澄清的石灰水中 加稀HCl时有气泡产生;石灰水变浑浊 固体中有碳酸钙。
或氢氧化钙 取小纸袋中少量固体于试管中,向试管中加入水,充分溶解后取上层清液,向清液中加无色酚酞。 酚酞试液由无色变红色 固体中有氢氧化钙
五、计算题(共13分)
30.(1)正确 (1分) (2)不能 (1分)
解:设产生氧气的质量为x
68 32
17g x
x=8g (2分) 答:略
(3)反应物中的某元素全部转化为所求的生成物时,两种解法才都适用。 (2分)
31.解:(1)设固体混合物中氯化钠的质量为x,反应后生成硝酸钠的质量为y,
NaCl + AgN03 === AgCl↓ + NaN03 ………………………………1分
58.5 143.5 85
x 14.35g y
58.5:143.5=x:14.35g x=5.85g ………………1分
143.5:85=14.35g:y y=8.5g ……………………1分
(2)反应后滤液中溶质的质量为12.35g—5.85g十8.5g=15g ……………1分
反应后滤液的质量为 12.35g+27g+75g—14.35g=100g …………2分
反应后滤液中溶质的质量分数 ……………1分
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。